在70余年化疗药物研发中,临床肿瘤学界一直秉持药物剂量越大抗肿瘤活性越强的观念。然而,靶向疗法抗肿瘤活性在超过一定剂量后不再增强,而药物毒性却会增加。药品监管机构通常将最大耐受剂量批准为临床标签剂量,而不进行严格剂量优化。因此,临床实践中经常需要调整剂量,以平衡疗效和毒性。
随着癌症患者数量增多,世界各国医疗系统都面临经济和运营方面的巨大挑战。近年来,有人从临床和卫生经济学出发提出抗肿瘤药物减量试验,旨在调整抗癌药物标签剂量,在保证抗肿瘤疗效同时,减轻支付方经济负担,降低患者毒性反应。我们综合NEJM、Nat Rev Clin Oncol等杂志文章,概述这一新动向。
减量试验的理论依据
2021年5月,美国食品药品管理局(FDA)批准了索托拉西布用于治疗携带KRAS p.G12C突变的转移性非小细胞肺癌(NSCLC)。索托拉西布是基于CodeBreaK100试验的2期部分获得批准,它是第一种靶向KRAS的药物。尽管取得了这一成就,但该药物的研发因为缺乏稳健的剂量探索而受到阻碍,因此FDA要求申办方开展上市后试验,对较小剂量进行评估。这一决策的依据是有数据表明,在接受药物注册试验中所使用剂量和接受较小剂量的患者之间,药代动力学药物暴露水平(体内药物水平)、靶点饱和度和肿瘤缓解率相似。
肿瘤药物剂量和用药方案在申办方启动注册试验之前未能充分明确的情况并不少见(表1)。目前的默认决策是选择已评估过的最大剂量,这样做是因为人们希望可选方案有限的患者可以快速获得抗肿瘤药物,也是因为人们认为药物剂量越大则治疗活性越强。目前的一般做法是向人数很少的几个患者队列分配递增剂量,并评估重度或危及生命的剂量限制性毒性,从而可以在一个治疗周期中确定最大耐受剂量。但对于靶向药物和生物疗法,应重新审视这一做法。
表1. 获得批准后因安全性或耐受性而修改剂量或用药方案的药物举例
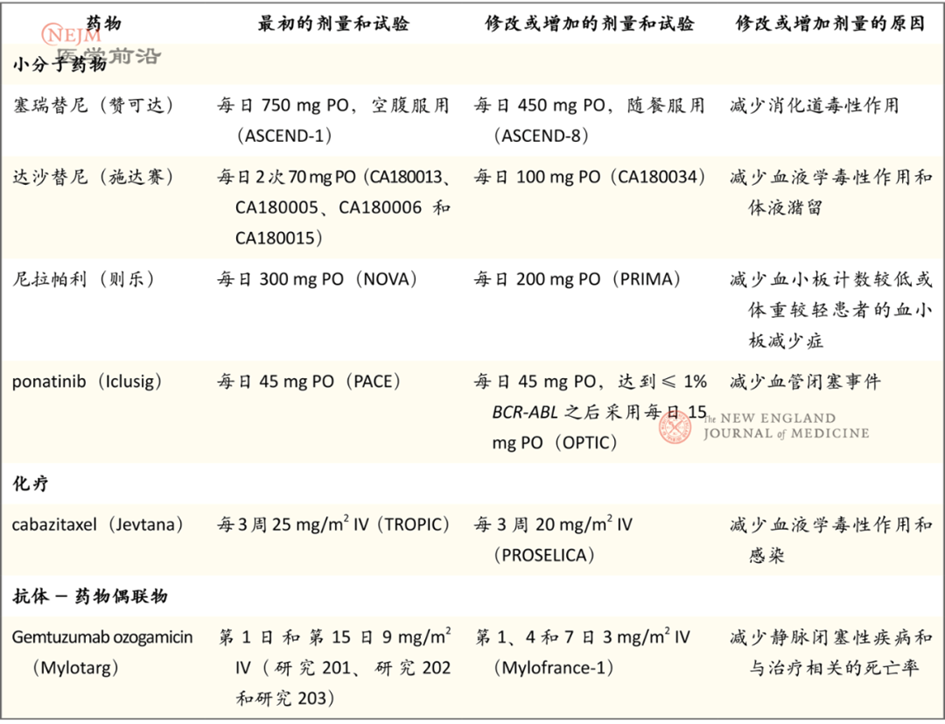
癌症生物学和分子遗传学领域的发展推动了多种靶向疗法的研发,包括激酶抑制剂、单克隆抗体和抗体-药物偶联物。这些药物延长了NSCLC、黑色素瘤和乳腺癌等各种癌症患者的生存期,它们在辅助治疗中的应用也带来了治愈癌症的可能性。对于靶向药物,超过一定剂量之后继续加大剂量可能不再增强抗肿瘤活性,剂量限制性毒性在有临床活性的剂量下可能并不会观察到,而严重毒性作用可能在多个周期的实验性治疗之后才会显现。患者可能会接受数月或数年的靶向药物治疗,因此评估长期耐受性变得更为重要。然而,“剂量越大越好”的模式仍被用于新型抗肿瘤药的剂量选择,但人们已认识到靶向疗法需要通过其他方法优化剂量。
在注册试验中指导剂量选择的是临床研发早期收集的药代动力学和药效学数据。完成最初的剂量递增试验后,应根据暴露水平、靶点饱和度和其他药效学指标选择两种或多种剂量,并在之后的随机试验中进行评估。尽管非劣效性比较在许多根据生物标志物定义,且人数较少的癌症患者亚组中可能并不可行,但从随机试验中收集的早期疗效、安全性和暴露水平-应答数据将支持我们更明智地选择剂量。
当申办方考虑基于单组疗效试验提交药物申请时,通过随机试验指导剂量选择可能也是一种可选方案。在这些情况下,可以进行一项早期随机试验,在试验中分析几种剂量的缓解率,并且为了选择剂量而进行预设的剂量-应答分析。之后,该试验可作为单组试验继续进行,纳入在随机试验中接受所选剂量的参与者,并且继续纳入新患者。在随机试验评估的不同剂量之间,疗效和安全性的差异可包含在药品说明书中。
在数种PD-1抗体的早期研发期间,研究者在随机和非随机队列中评估了药物的多种剂量,并进行了广泛的临床药理学分析,因此才了解了受体占有率,以及暴露水平和应答(在疗效和安全性方面)之间的关系。帕博利珠单抗和纳武利尤单抗的初始试验均评估了很大的剂量范围。来自这些试验和建模的剂量和暴露水平-应答数据促使申办方在保持药物疗效的同时,选择了比研究中最大剂量要低的剂量。
早期评估与安全性和疗效相关的剂量和暴露水平-应答数据可指导我们基于特定人群的药物暴露水平选择剂量,其中包括器官功能障碍患者和接受其他药物治疗的患者。这些分析中得到的信息还有可能加速联合用药的研发,以及推动儿童患者用药方案的研发。在早期试验中纳入少数族裔患者和老年患者可提供更多关于剂量和安全性的数据,这些数据可在后续试验中进一步评估。
为细胞毒性药物选择剂量时,人们重点关注的是在可能已尝试过多种治疗方案,并且一般短期(主要是因为疾病进展)参与剂量探索试验的癌症患者中发现重度和危及生命的毒性作用。对于靶向药物,慢性、低级别毒性作用可能会妨碍长期用药,需要减小剂量和延迟给药,并且可能影响患者对治疗方案的依从性,这些都可能导致疾病进展。选择剂量时,一定要考虑低级别毒性作用和剂量调整的发生频率,包括可能在第一个治疗周期之后出现的毒性作用和剂量调整。
开发更便利的用药方案可能也有助于患者按照建议用药,而药物研发期间对剂量优化进行的稳健评估可能使人们有机会进一步优化剂量。过去一年间,FDA批准了帕博利珠单抗和西妥昔单抗延长用药间隔期的方案。研究者也为静脉注射药物开发出了皮下给药制剂,例如复方药达雷妥尤单抗+透明质酸酶-fihj和固定剂量复方药曲妥珠单抗+帕妥珠单抗+透明质酸酶-zzxf。这些方案和制剂获批后减少了癌症患者在COVID-19疫情期间的门诊次数,并且提高了用药便利性和安全性。
减量试验的研究设计
以往的一系列临床研究体现了成功的减量试验设计。简而言之,可能的剂量减少方案包括:(1)直接降低标签剂量;(2)减少每个治疗周期的给药时间和/或频率,包括延长治疗周期;(3) 缩短总治疗时间,包括在可测量微小残留病(MRD)指导下停止治疗。
在复发和/或难治性慢性淋巴细胞白血病患者中进行的一项试验支持了最后一个概念。简而言之,患者先接受15个周期维奈克拉+伊布替尼治疗,然后MRD阳性患者接受伊布替尼维持治疗。接受15个周期联合治疗后MRD阴性的患者(35%)被随机分配接受伊布替尼维持治疗或在MRD指导下停止治疗并在MRD阳性后重新开始治疗。结果显示,在停止伊布替尼维持治疗的患者中,98%的患者在超过12个月后仍保持MRD阴性。
特别需要指出的是,与接受伊布替尼维持治疗的患者相比,MRD阴性但未接受维持治疗患者的严重不良事件发生率大幅降低(8% vs. 33%)。此外,MRD阴性患者停止治疗后,在约12个月内可节省100%的药物费用,这凸显了减量试验后巨大的成本效益潜力。因此,在减量试验中应用基于MRD或生物标志物的治疗应答监测是一种非常有吸引力的策略,不仅可以对药物剂量进行个体化优化,还可以早期发现需要剂量升级或替代治疗的难治性和/或进展性疾病患者。
除了常规的临床终点(如缓解率、生存结局和不良事件)外,药物减量试验最好还采用一系列标准化的补充终点,如生活质量、住院次数、所需的工时和治疗相关费用。
障碍
目前,制药公司赞助的临床试验不仅有大量的经费支持,而且还能探索新的治疗模式,因此,对于临床试验单位及研究者而言,在经济和学术上都比药物减量试验更具吸引力。不过,由政府资助的研究者发起的临床试验(IIT)则可考虑开展药物减量试验,并同时开展全面的探索性学术研究。理想情况下,此类研究计划应探索新的诊断方法,以改进疗效监测(如MRD检测)和治疗分层,并探索适用于原发耐药或疾病复发患者分子靶向治疗的新药物靶点和/或生物标志物。
成功的药物减量试验将为抗癌药物制定标签外的减量方案,这可能会促使制药公司注册新的、标签剂量更低的药物适应证,或者提高已批准标签剂量的价格,以弥补收入损失。然而,制药公司可能不愿意采取这些行动,因为这些行动的成本相当高,很可能会引发公众对其定价政策的批判,而且如果价格过高,可能会导致其药物被剔除医保系统。
资金和组织
由于制药公司不愿意资助药物减量试验,因此需要公共资金来支持研究者发起的药物减量试验,这些试验结果极有可能减少治疗所花费的时间和药物成本。理想情况下,这需要为临床试验团队提供协调一致的政治和经济支持,以执行对国家医疗保健系统和患者具有最高成本效益潜力的药物减量试验。100名患者每年的试验费用与估计平均节省的药物成本(欧洲为400~500万欧元,美国为930万欧元)相比要少很多,政府机构很可能强烈支持临床试验团队开展药物减量试验。
为此,有必要建立跨学科药物减量试验团队,由国家医疗系统和/或国际医疗组织(如欧盟甚至世界卫生组织)集中组织和资助。这种跨学科药物减量试验团队应包括试验执行人员(护士、试验协调员和医生)以及卫生经济学、统计学和药理学专家,负责对已获批准的癌症药物或治疗方案进行认真审查,并优先考虑那些年度预算成本最高、有可能减少不良事件和/或医疗资源利用(包括药物支出和诊疗时间)同时又能保持疗效的药物减量试验。正如以往研究发现的那样,化疗药物、小分子抑制剂和生物制剂等不同类别的药物可能均适合减量。
结论
旨在优化剂量反应的药物减量试验为患者和国家医疗系统提供了一个非常必要的双赢战略。药物减量试验可能会降低许多抗癌药物不必要的高标签剂量,将有助于减少毒性反应和住院次数,从而改善众多患者的生活质量。减少用药剂量或缩短用药时间还具有降低成本和减少诊疗时间的巨大潜力,考虑到这些领域迫在眉睫的挑战,这是确保国家医疗保健系统未来运作和经济可持续性的先决条件。
药物减量试验还可能影响国家医药监管机构对抗癌药物的审批和报销,因为许多国家的医药监管机构主要依赖于成本效益评估(即相对于替代治疗方法而言,获得每个生命年所需的成本),而非关于药物成本和预算的简单信息。事实上,药物减量试验将为这些机构提供宝贵的真实世界信息,既包括药物成本,也包括患者的治疗效果和生活质量。
对于最初因标签剂量导致药物的成本效益低而被拒之门外的新型抗癌药物,成功的药物减量试验有可能提高健康经济评估中质量调整生命年的数量,从而获得批准和报销。总之,"少即是多",国家医疗保健系统对药物减量试验的公共投资不仅可以通过节省药物成本和工时获得数倍的回报,最重要的是还能使越来越多的癌症患者受益。
参考文献
1. Theilgaard-Mönch K, Ehlers LH. Dose-reduction trials in oncology — aiming for less toxicity and better quality of life at lower costs. Nat Rev Clin Oncol 2024;21:81–2.
2. Shah M, Rahman A, Theoret MR, et al. The drug-dosing conundrum in oncology - when less is more. N Engl J Med 2021;385:1445-1447.
来源:NEJM医学前沿














